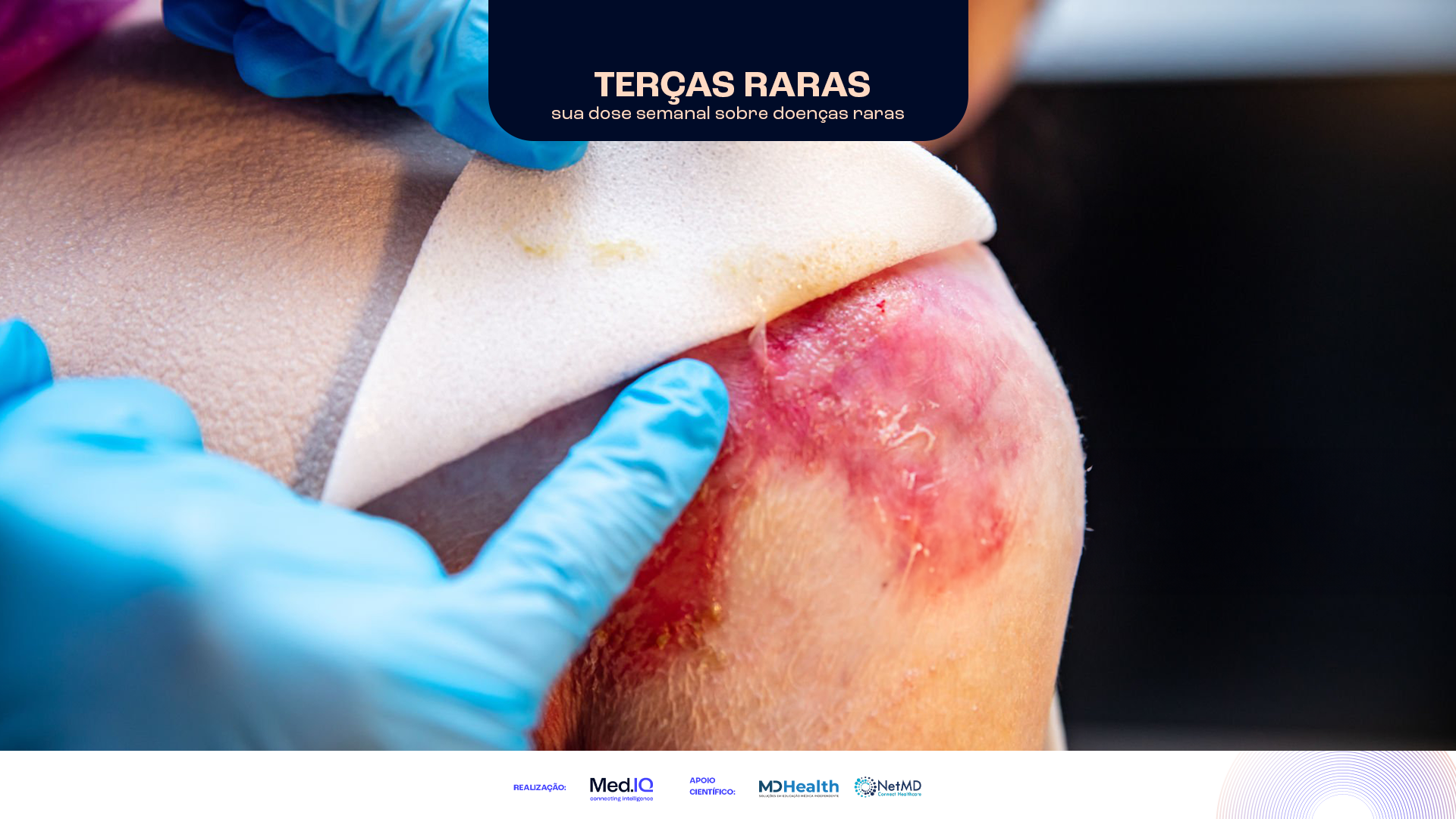
O Vyjuvek, aprovado pela FDA, demonstra eficácia em estudo clínico de fase III, com 65% das feridas tratadas apresentando fechamento...
Doenças Raras na Infância: Avanço no Tratamento da Epidermólise Bolhosa Distrófica com Terapia Gênica Tópica
Escrito por: Samara Alves em 7 de janeiro de 2025
4 min de leitura
Referências
Khan A, Riaz R, Ashraf S, Akilimali A. Revolutionary breakthrough: FDA approves Vyjuvek, the first topical gene therapy for dystrophic epidermolysis bullosa. Ann Med Surg (Lond). 2023;85:6298-6301.
Efficacy and safety data. Vyjuvek HCP. Disponível em: https://www.vyjuvekhcp.com/efficacy-safety-data/#efficacy-safety-safety-data. Acesso em 3 jan. 2025.

 Vea MedIQ en Español
Vea MedIQ en Español